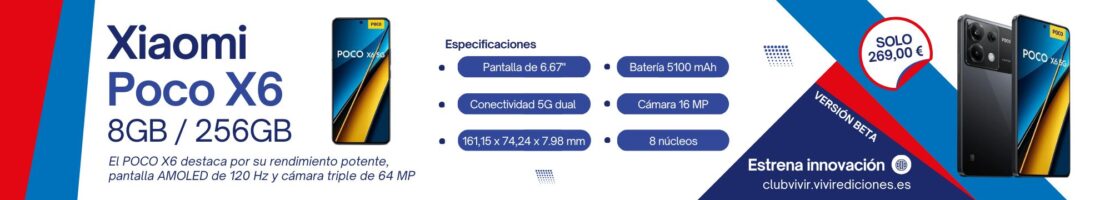
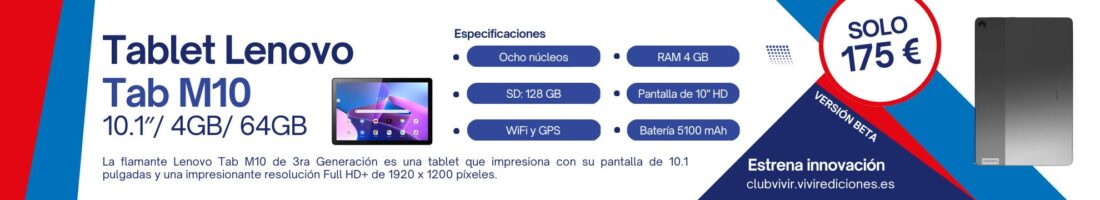
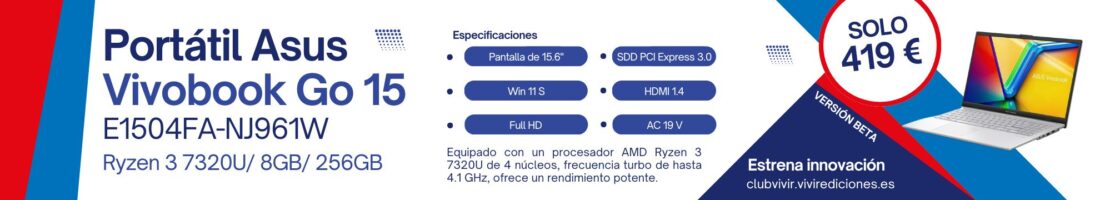
La estrategia de vacunación está pendiente de decisiones clave, algunas de las cuales, como qué hacer con la administración de la vacuna de Janssen, tienen que resolverse en la Agencia Europea del Medicamento (EMA) este martes, día en el que la Comisión de Salud Pública se reúne con varios asuntos de calado a debate
La estrategia de vacunación está pendiente de decisiones clave, algunas de las cuales, como qué hacer con la administración de la vacuna de Janssen, tienen que resolverse en la Agencia Europea del Medicamento (EMA) este martes, día en el que la Comisión de Salud Pública se reúne con varios asuntos de calado a debate.
En un momento en el que las comunidades autónomas alertan de la falta de vacunas, será clave el pronunciamiento de la Agencia Europea sobre la administración de Janssen.
La EMA ha investigado los seis casos de trombos muy raros detectados en pacientes vacunados con esta monodosis en Estados Unidos, donde unos 6,8 millones de personas ya han recibido el suero de esta filial de Johnson & Johnson. Un pronunciamiento favorable permitirá acelerar las inmunizaciones en Europa, que tiene precontratadas 400 millones de dosis de esta marca.
España tiene almacenadas las primeras 150.000 vacunas de Janssen, que llegaron justo cuando la farmacéutica decidió paralizar la distribución cautelarmente.
Este lunes se ha conocido uno de los borradores en los que trabaja la Comisión de Salud Pública, donde se aborda la conveniencia de aumentar el intervalo entre la primera y la segunda dosis de la vacuna contra el coronavirus para los menores de 79 años, con el fin de acelerar la inoculación de al menos un suero al mayor número de personas vulnerables, en la línea de lo que ha hecho Gran Bretaña.
En concreto, el documento propone continuar con la separación de segundas dosis de Pfizer y Moderna tal como se recoge en la estrategia actual (21 días y 28 días, respectivamente) pero aumentar el intervalo en los menores de 79 años entre seis u ocho semanas.
Por el momento, la Agencia Europea del Medicamento (EMA) ha avisado de que las vacunas de la covid-19 autorizadas «deben usarse tal y como se describe en el prospecto del producto», lo que se traduce en dos dosis con «tres semanas» de diferencia entre la primera y la segunda en el caso de Pfizer/BioNTech y «28 días» para Moderna.
El director del Centro de Coordinación de Alertas y Emergencias Sanitarias, Fernando Simón, ha querido precisar que este es un documento en el que se exponen opiniones, y que no es «bueno que se discuta de borradores porque se mediatiza la discusión de los técnicos».
La Comisión de Salud Pública reúne a técnicos del Ministerio y de las comunidades autónomas, que después elevan sus acuerdos al Consejo Interterritorial donde los consejeros autonómicos y el Gobierno deciden.
El Gobierno y las comunidades autónomas tienen también pendiente decidir si administrar la segunda dosis de AstraZeneca a los menores de 60 años ya vacunados con la primera o apostar por la inoculación de otra vacuna.
Tras decidirse que este vacuna quedaba prescrita para los mayores de 60, unos dos millones de personas menores de esta edad están pendientes aún de saber si van a recibir la segunda dosis de AstraZeneca, bien de otra farmacéutica o ninguna más.
Al respecto, Fernando Simón opina que esta vacuna está teniendo un «resultado muy bueno» en el control de la epidemia y «no se ha descartado todavía del todo» administrar la segunda dosis, aunque ya se estudia si conviene administrar la segunda dosis con Pfizer.
Precisamente, la Agencia Española del Medicamento ha autorizado este lunes el primer ensayo clínico que evalúa la seguridad y el efecto protector de administrar Pfizer a los ya vacunadas con AstraZeneca. Hay 600 voluntarios.
Por otra parte, la Comisión de Salud Pública tiene sobre la mesa otros documentos a debate, entre ellos las recomendaciones ante la reactivación progresiva de eventos y actividades multitudinarias y la prohibición de fumar en las terrazas.
Fuente: © EFE 2021